ニュンベルク綱領とヘルシンキ宣言(3)
今回のコラムは前回、前々回コラムにつづいて第3回目となります。
今回の内容はタイトルのとおり、ニュンベルク綱領とヘルシンキ宣言についてですが、ヘルシンキ宣言について伝えます。
ヘルシンキ宣言は、人間を対象とする医学研究の倫理指針です。これは、第二次世界大戦中のナチスによる非人道的な人体実験への反省から生まれた「ニュルンベルク綱領」の理念を発展させたものです。
ニュルンベルク綱領で示された「被験者の自発的同意」という基本原則を継承しつつ、ヘルシンキ宣言では、研究計画の倫理委員会による審査、被験者の利益を研究の利益より優先することなどを具体的に規定しました。医師自らが定めた、より実践的な倫理規範である点に特徴があります。

ヘルシンキ宣言:現代医学倫理の礎石—歴史的要請から世界的基準へ
第1章 倫理規制の道徳的要請:歴史的背景
ヒトを対象とする医学研究における倫理規範の確立は、単なる学術的な進展ではなく、20世紀に起きた数々の非人道的な出来事に対する道徳的、そして社会的な応答でした。ヘルシンキ宣言の真の重要性を理解するためには、まずその採択を不可避なものとした、暗い歴史的背景を深く掘り下げる必要があります。倫理的監視が不在であった時代、科学的探求心の名の下に、人間の尊厳が組織的に踏みにじられた事実が存在します。
1.1 非倫理的な人体実験の影
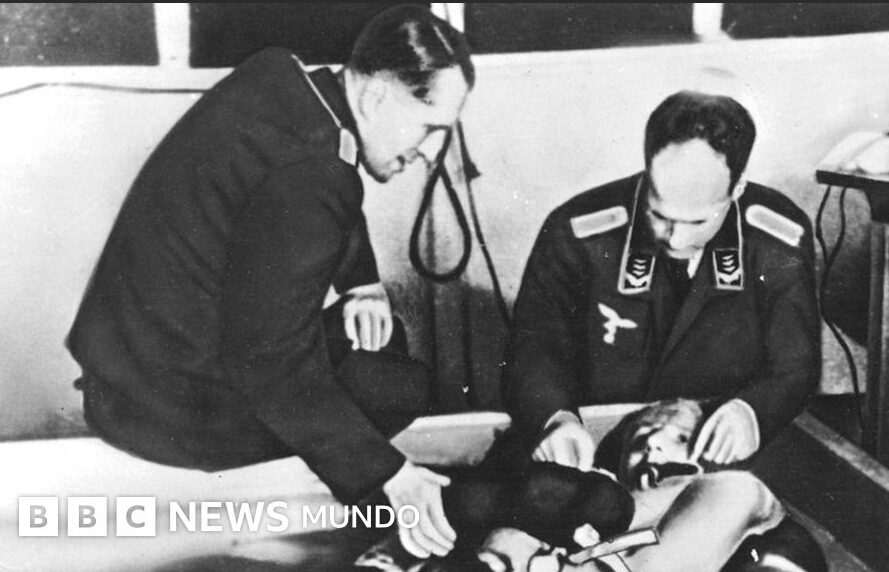
20世紀を通じて行われた非倫理的な人体実験は、一部の逸脱した研究者による偶発的な行為ではありませんでした。むしろ、多くの事例において、それは国家や権威ある医療機関によって支持され、組織的に実行されたものでした。この体系的な倫理の欠如こそが、ニュルンベルク綱領、そして後のヘルシンキ宣言という普遍的な倫理規範の創設を促した根源的な要因です 。
その最も悪名高い例が、第二次世界大戦中にナチス・ドイツの医師たちが強制収容所で行った医学実験です。これらは国家が支援した研究プロジェクトであり、被収容者を単なる「実験材料」として扱いました 。ユダヤ人やロマの女性を対象とした断種実験、低圧・低温環境への曝露実験、意図的な病原菌感染実験など、その内容は残虐を極めました 。これらの戦争犯罪は、戦後の「医者裁判」の直接的な契機となり、研究倫理という概念を国際社会に突きつけることになりました。
しかし、このような非倫理的な研究は、ナチス・ドイツという特定の全体主義体制下でのみ行われたわけではありません。民主主義国家であるアメリカ合衆国においても、深刻な倫理違反が長期間にわたり行われていました。その象徴的な事例が、1932年から1972年にかけて実施された「タスキギー梅毒研究」です。この研究では、米国公衆衛生局が主導し、アフリカ系アメリカ人男性399名を対象に、梅毒の自然経過を観察するという目的で、彼らに真の病名を知らせず、有効な治療薬であったペニシリンが普及した後も意図的に治療を行いませんでした。この事件は、非倫理的な研究が特定のイデオロギーの問題だけでなく、社会的な弱者が搾取される構造的な問題であることを浮き彫りにしました。
こうした倫理的逸脱は、世界的な現象でした。ニューヨークのウィローブルック州立学校では知的障害のある子供たちに肝炎ウイルスを接種する研究が行われ、ユダヤ人慢性疾患病院では認知症の高齢患者に本人の同意なくがん細胞が注射されました 。さらに、グアテマラでは、米国の研究者が関与し、囚人や兵士、精神疾患者らに意図的に梅毒を感染させる実験が行われていた事実も明らかになっています 9。日本においても、戦時中の九州大学における米軍捕虜の生体解剖事件や、戦後の精神病院でのツツガムシ病菌接種実験など、科学的進歩の名の下に個人の人権が無視された事例が存在します。
これらの事例に共通するのは、個々の研究者の道徳的欠陥というよりも、むしろ研究対象者の福祉よりも知識の獲得を優先する当時の医学研究界全体のシステム的な欠陥です。国家、医療機関、研究者コミュニティが一体となって、あるいは見て見ぬふりをして、非倫理的な行為を容認、あるいは推進していたのです。この根深いシステムの問題を解決するためには、単に既存の法律を適用するだけでは不十分であり、医学研究という特殊な活動領域に特化した、新たな倫理的枠組みそのものを構築することが不可欠でした。
1.2 ニュルンベルク綱領(1947年):研究倫理の最初の金字塔
ナチスの非道な人体実験への直接的な応答として生まれたのが、1947年のニュルンベルク綱領です。これは、ニュルンベルク継続裁判の一環として行われた「医者裁判」の判決文の中で示された、ヒトを対象とする研究に関する一連の倫理原則です。
この綱領は、研究倫理の歴史における最初の、そして極めて重要な一歩でした。その核心は、以下の10の要点に集約されています 1。
- 被験者の自発的な同意は絶対不可欠である。
- 実験は、社会の利益に貢献する実りある結果を生むものでなければならない。
- 実験は、動物実験の結果と疾患の自然史に関する知識に基づいて計画されなければならない。
- 実験は、不必要な身体的・精神的苦痛や傷害を避けるように実施されなければならない。
- 死亡や障害をもたらすと信じるべき理由がある実験は実施してはならない。
- 実験に伴うリスクの程度は、その実験によって解決されるべき問題の人道上の重要性を超えてはならない。
- 被験者を傷害、障害、死亡といったわずかな可能性からも保護するため、十分な準備と適切な設備が提供されなければならない。
- 実験は、科学的に資格のある者によってのみ実施されなければならない。
- 被験者は、実験のいかなる段階においても、実験を中止する自由を有するべきである。
- 研究者は、実験の継続が被験者に傷害、障害、または死亡をもたらす可能性があると信じる理由がある場合、いかなる段階においても実験を中止する準備ができていなければならない。
特に第一条の「被験者の自発的同意の絶対的な必要性」は、被験者の自律性を倫理の中心に据える画期的な原則でした。しかし、ニュルンベルク綱領は、その成立背景から、主に健康なボランティアを対象とした非治療的な研究を想定しており、いくつかの限界も抱えていました。例えば、医師が患者に対して行う治療と研究が一体となった「臨床研究」の複雑な状況には、必ずしも十分に対応できるものではありませんでした。綱領の厳格な文言は、患者の利益のために新しい治療法を試みるという、医療現場の現実に適用するには硬直的すぎると見なされることもありました。
1.3 医師主導の枠組みへの要請
ニュルンベルク綱領が、戦争犯罪を裁く法廷という外部からの判断であったのに対し、医学界内部からは、より実践的で、医師の専門的良心に根ざした倫理規範の必要性が認識されるようになりました。1947年に設立された世界医師会(WMA)は、この役割を担うことになります。
その根本的な動機は、ニュルンベルク綱領が主に想定していなかった「臨床研究」の領域に特化した倫理指針を策定することでした。臨床研究において、医師は患者の健康を守る「治療者」としての役割と、新しい知識を得るための「研究者」としての役割という、二重の責任を負います。この潜在的な利益相反を適切に管理し、いかなる状況でも患者の利益を最優先するための、医師自身による、医師のための行動規範が求められたのです。
この動きは、研究倫理のガバナンスにおける極めて重要な転換点を意味します。それは、外部の法的な裁きから、医学という専門職が自らの行動を律する内的な責任へと、倫理の所在を移行させる試みでした。一部の医師にとって、ニュルンベルク綱領は「野蛮な行為」に対する規範であり、良心的な医師が日常的に直面する倫理的ジレンマに答えるものではないと捉えられていました。また、「絶対不可欠な同意」という要件は、同意能力のない患者や、治療が研究と密接に結びついている状況への適用が困難でした。
したがって、WMAによるヘルシンキ宣言の策定は、単に既存の規範を改良する以上の意味を持つ、専門職としての自己規制行為でした。それは、「これこそが、法が定める最低限の基準を超え、我々が臨床現場で直面する固有の倫理的課題に対応するための、我々自身の基準である」という医学界の宣言だったのです。この倫理的権威の源泉を外部から内部へと転換させたことこそが、ヘルシンキ宣言が世界中の医師に受け入れられ、永続的な影響力を持つに至った本質的な理由の一つと言えるでしょう。
第2章 ヘルシンキ宣言(1964年):医学研究の新たな憲章
1964年に採択されたヘルシンキ宣言は、ニュルンベルク綱領が築いた基礎の上に、より洗練され、臨床現場の実情に即した倫理原則を打ち立てました。それは、医学研究のあり方を根本から問い直し、被験者保護を絶対的な中心に据えるという、新たな時代の到来を告げるものでした。
2.1 創設と採択
ヘルシンキ宣言は、1964年6月、フィンランドのヘルシンキで開催された第18回世界医師会(WMA)総会において採択されました。その正式名称は「ヒトを対象とする医学研究の倫理的原則」であり、その目的が臨床研究を含む広範な医学研究の倫理的指針を示すことにあると明確に示されていました。これは、医学界が自らの手で、研究に関わるすべての医師が従うべき普遍的な規範を世界に向けて発信した、歴史的な瞬間でした。
2.2 根源的な哲学的転換:研究参加者の優先
ヘルシンキ宣言がもたらした最も根源的かつ革新的な貢献は、倫理的な優先順位を明確に定義した点にあります。それは、「個々の研究参加者の福利に対する配慮は、科学的および社会的利益よりも優先されなければならない」という原則です。
この一文は、過去の多くの非倫理的な人体実験を正当化するために用いられてきた「より大きな善のため」という功利主義的な論理を、明確に否定するものでした。個人の犠牲を社会全体の利益の名の下に許容する考え方に対し、ヘルシンキ宣言は、研究に参加する一人ひとりの人間の生命、健康、尊厳は、いかなる科学的目標や公衆衛生上の利益よりも尊重されなければならないという、揺るぎない倫理的階層を確立したのです。この原則は、現代の研究倫理全体の礎石となっています。
さらに宣言は、この保護責任を医師の根源的な義務として位置づけました。それは、医師の知識と良心が、何よりもまず患者の健康を促進し保護するために捧げられるべきであるという、古くからの医療倫理と直結しています。これにより、研究活動は、医師が持つ治療者としての基本的な責務の延長線上にあるべきであり、決してそれと矛盾するものであってはならないという考え方が示されました。
2.3 1964年宣言の主要な教義
1964年の初版宣言は、その後のすべての改訂の基礎となる、いくつかの重要な原則を導入しました。
- インフォームド・コンセントの精緻化: 宣言はニュルンベルク綱領からインフォームド・コンセントの原則を引き継ぎましたが、それを臨床の現実に合わせてより精緻化しました。特に、被験者が法的に同意能力を欠く場合(例えば、未成年者や意識のない患者)、法定代理人から同意を取得することを認めました。これは、ニュルンベルク綱領では明確に扱われていなかった点で、脆弱な立場にある患者を含む臨床研究に倫理原則を適用するための、現実的かつ不可欠な規定でした。
- 治療的研究と非治療的研究の区別: 初版宣言は、「職業的責務と結合した臨床研究(治療的研究)」と「純粋に科学的な目的のための非治療的臨床研究」とを明確に区別しました。これは、研究が患者参加者にとって直接的な治療上の利益をもたらす可能性がある場合と、純粋に知識の獲得を目的とする場合とでは、倫理的な配慮のあり方が異なることを認識した、重要な区別でした。治療的研究においては、新しい治療法がもたらす利益とリスクを、既存の最善の治療法と比較考量することが求められました。
- リスク・ベネフィット評価の義務化: 宣言は、研究に伴う予見可能なリスクが、期待される利益によって正当化される場合にのみ、研究を実施すべきであると規定しました。そして、研究の途中でリスクが利益を上回ると判断された場合には、研究を中止しなければならないと明確に義務付けました。これにより、研究の計画段階から終了に至るまで、継続的なリスク評価が倫理的な必須要件となりました。
- 科学的妥当性の要求: 倫理的な研究は、科学的にも妥当でなければならないという原則も確立されました。宣言は、ヒトを対象とする研究は、十分な実験室での研究や動物実験、そして関連する科学文献の深い知識といった、一般に受け入れられた科学的原則に基づかなければならないと要求しました。これは、科学的に質の低い研究は、参加者を不当なリスクに晒すだけで価値ある知見をもたらさないため、本質的に非倫理的であるという考え方を示唆しています。
2.4 独立した審査の導入
ヘルシンキ宣言のもう一つの画期的な点は、研究者や研究依頼者から独立した第三者による倫理的監視の概念を導入したことです。1964年の初版では、「研究計画書は、検討、意見、指導を求めるため、特別に任命された独立の委員会に送付されるべきである」と述べられました。
この時点ではまだ「勧告」のレベルでしたが、この「独立委員会」という概念は、今日の研究倫理審査委員会(REC)や施設内倫理審査委員会(IRB)の原型となりました。研究の倫理的正当性を、研究の実施に直接的な利害関係を持たない委員会が事前に審査するというこの仕組みは、研究者の自己判断だけに委ねることの危険性を認識し、客観性と説明責任を確保するための制度的保障を導入する、極めて重要な一歩でした。この原則は、後の1975年の改訂で正式に「義務」へと格上げされ、現代の研究ガバナンスにおける不可欠な柱となります。
第3章 生きた文書:改訂を通じての宣言の進化(1975年~2024年)
ヘルシンキ宣言は、一度採択されて終わりという静的な文書ではありません。それは、医学の進歩、新たな倫理的課題の出現、そして研究における正義についての理解の深化に対応するため、繰り返し改訂されてきた「生きた文書」です。60年にわたるその進化の歴史は、医学倫理が直面してきた挑戦の歴史そのものを映し出しています。
3.1 初期の改訂(1975年東京~1996年サマーセット・ウェスト):基盤の確立
初期の改訂は、宣言の基本的な枠組みを強化し、より具体的な指針を示すことに重点が置かれました。
- 1975年(東京): この改訂は、ヘルシンキ宣言の歴史において極めて重要な転換点となりました。1964年版では勧告に留まっていた「独立した委員会による審査」が、正式な義務として規定されたのです。これにより、研究倫理審査委員会(REC/IRB)による事前の計画書審査と承認が、倫理的な医学研究を実施するための必須条件として制度化されました。倫理的監視が研究者の任意から制度的保障へと移行したこの改訂は、研究ガバナンスのあり方を恒久的に変えました。この重要な総会が東京で開催されたことは、宣言の原則が早期からグローバルに受容されていたことを示しています。
- 1983年(ヴェネツィア)および1989年(香港): これらの改訂では、より細かな点が明確化されました。特に、子どもを対象とする研究に関する配慮が追加され、可能な場合には本人の同意(アセント)を得ることの重要性が盛り込まれました。
- 1996年(サマーセット・ウェスト): この改訂では、後に大きな議論を呼ぶことになる条項が追加されました。それは、プラセボ(偽薬)の使用に関するもので、「証明された有効な治療法が存在する場合には、プラセボを対照群として用いるべきではない」という趣旨の一文が加えられたのです。この規定は、臨床試験における対照群の倫理に関する、長年にわたる議論の幕開けとなりました。
3.2 2000年エディンバラ改訂:論争と明確化
2000年のエディンバラ総会で採択された改訂は、宣言の歴史の中で最も大きな論争を巻き起こしました。
- プラセボを巡る論争: この改訂では、プラセボの使用に関する文言がさらに強化されました。これに対し、特に開発途上国で研究を行う研究者や製薬業界から強い反発が起こりました。彼らの主張は、先進国で「標準治療」とされる高価な薬剤が、研究実施国では経済的な理由から利用不可能である場合、プラセボ対照試験以外に新薬の有効性を証明する現実的な方法がない、というものでした。一方、擁護派は、治療可能な疾患を持つ患者に意図的にプラセボを投与することは、たとえそれが現地の標準治療でなくても非倫理的であると主張しました。この対立は、普遍的な倫理基準と、世界各地の医療格差という現実との間の深刻な緊張関係を浮き彫りにしました。この論争の影響は大きく、米国食品医薬品局(FDA)はこの改訂版を承認せず、しばらく1989年版を引用し続けた後、最終的に宣言への言及自体を取りやめるという事態に至りました。
- 試験後のアクセス: この改訂では、研究終了後に関する倫理的責務も強化されました。研究で有効性が証明された治療や介入について、参加者が試験終了後にもアクセスできるような取り決めを事前に計画書に記載すべきであるとされたのです。これは、研究者が開発途上国で臨床試験を実施し、データだけを収集して去っていく「研究パラシュート主義」と呼ばれる搾取的な行為への批判に応えるものでした。
- 出版倫理: 研究成果の公表に関する倫理的義務が改めて強調され、肯定的な結果だけでなく、否定的および結論に至らなかった結果も公表しなければならないと明記されました。これは、出版バイアスを防ぎ、科学的知見の全体像を歪めることなく共有するための重要な規定です。
3.3 2008年および2013年の改訂:新たな領域への対応
21世紀に入り、宣言は新たな科学技術や社会の変化に対応するための改訂を重ねました。
- 2008年(ソウル): この改訂の大きな進展は、すべての臨床試験を、最初の被験者を登録する前に、公的にアクセス可能なデータベースに登録することを義務付けたことです。これにより、研究の透明性が飛躍的に向上し、結果の選択的公表を防ぐための重要な仕組みが整いました。また、研究が環境に与える影響への配慮や、研究に用いられる動物の福祉の尊重といった、より広い視野に立つ原則も初めて盛り込まれました。
- 2013年(フォルタレザ): この改訂は、脆弱な立場にある人々の保護強化に重点を置きました。彼らを研究に含める際には、その正当性を特に厳密に論証することが求められるようになりました。また、現代の医学研究の進展を反映し、バイオバンクなどに保管されるヒト由来の生体試料やデータの将来的な利用について、収集時に明確な同意を得るべきであるという規定が追加されました。さらに、研究参加によって生じた損害に対する適切な補償と治療を保証する条項や、進行中の研究を監視する倫理委員会の権限強化も盛り込まれました。
3.4 2024年の改訂:現代的研究のパラダイム
直近の改訂は、研究倫理に関する最新の考え方を反映し、より参加者中心のアプローチへと大きく舵を切りました。
- 参加者中心の言語: 文書全体で「被験者(subjects)」という用語を「参加者(participants)」に置き換えるという、象徴的かつ重要な変更が行われました。これは、研究対象者を単なるデータ源としてではなく、科学の進歩における対等なパートナーとして尊重する姿勢を示すものです。
- 意義のある関与: 研究の計画、実施、結果の普及といった各段階において、参加者やそのコミュニティと「意義のある関与」を行うことを研究者に求めています。これにより、研究が参加者の価値観や優先順位を反映した、より協力的で公平なものになることが期待されます。
- 脆弱性と公平性: 脆弱な立場にある人々に関する考え方も見直されました。従来のように、彼らを保護の名の下に画一的に研究から排除することは、結果としてその集団に関する医学的知識の欠如を招き、健康格差を助長しかねないという反省に基づいています。新たなアプローチは、適切な保護策を講じた上で、彼らを研究に含める方法を模索することに重点を置いています。
- 新たな倫理領域: 宣言は、初めて研究活動の環境持続可能性に言及し、廃棄物を最小限に抑える努力を促しています。また、デジタル化時代に対応し、電子的インフォームド・コンセント(e-consent)に関する規定も導入されました。さらに、試験で有益性が示された介入への試験後のアクセスに関する要件も強化されています。
表1:ヘルシンキ宣言の主な改訂の経緯と主要な修正点
| 年・WMA総会開催地 | 主要な修正点 | 意義・背景 |
| 1964年(ヘルシンキ) | ・研究参加者の福利が科学・社会的利益に優先する原則を確立 ・代理同意(Proxy Consent)の概念を導入 ・治療的研究と非治療的研究を区別 ・独立委員会による審査を勧告 | ニュルンベルク綱領の法的枠組みから、医師主導の臨床研究向け倫理ガイドへと転換。 |
| 1975年(東京) | ・独立した倫理審査委員会による研究計画の事前審査を義務化 | 倫理的監視を制度化し、研究ガバナンスの根幹を確立。研究者の自己判断から客観的審査へ移行。 |
| 1983年(ヴェネツィア) | ・未成年者からの同意(アセント)取得の重要性を追加 | 脆弱な集団である子どもたちの自律性を尊重する方向性を明確化。 |
| 1996年(サマーセット・ウェスト) | ・証明された有効な治療法が存在する場合のプラセボ使用を制限する条項を追加 | 臨床試験における対照群の倫理に関する議論の端緒となり、後の大きな論争につながる。 |
| 2000年(エディンバラ) | ・プラセボ使用に関する規定を強化 ・研究終了後の介入へのアクセスに関する要件を強化 ・否定的結果を含む全研究結果の公表義務を明記 | 最も論争の多い改訂。普遍的倫理基準と各国の医療格差との緊張が表面化。研究の透明性と社会的責任を強調。 |
| 2008年(ソウル) | ・臨床試験の事前登録を公的データベースに義務化 ・環境への配慮と動物福祉の尊重を初めて言及 | 研究の透明性を抜本的に向上させ、説明責任を強化。倫理の範囲を人間以外にも拡大。 |
| 2013年(フォルタレザ) | ・脆弱な集団の保護を強化し、研究に含める際の正当化を要求 ・生体試料やデータの二次利用に関する同意規定を拡大 ・研究関連の損害に対する補償と治療の条項を追加 | バイオバンクやゲノム研究など、新たな科学技術に対応。参加者保護の具体策を拡充。 |
| 2024年(ヘルシンキ) | ・用語を「被験者」から「参加者」へ変更 ・参加者・コミュニティとの「意義のある関与」を要求 ・脆弱な集団の画一的排除ではなく、適切な保護下での参加を促進 ・環境持続可能性、電子的同意に関する規定を新設 | 研究をパートナーシップとして再定義。公平性、協調性、現代性(デジタル化・環境配慮)を重視するパラダイムへ移行。 |
第4章 世界的影響と各国の法制化
ヘルシンキ宣言は、国際法としての直接的な法的拘束力を持つ文書ではありません。しかし、その影響力は絶大であり、世界各国の国内法や規制にその原則が取り入れられることで、実質的な権威を確立してきました。この現象は、一見すると矛盾しているように見えます。法的拘束力のない文書が、いかにして世界の研究倫理の法的基盤となり得たのでしょうか。
その答えは、宣言が持つ圧倒的な「道徳的権威」にあります。ヘルシンキ宣言は、世界の医学界が合意した倫理のゴールドスタンダードとして認識されています。そのため、各国政府や規制当局が自国の法律や指針を策定する際、その原則を無視することは事実上不可能です。宣言は、いわば倫理の「ソースコード」として機能し、それが各国の法制度という「アプリケーション」にコンパイル(翻訳・実装)されることで、世界中にその効力を及ぼしているのです。この間接的でありながらも根源的な影響力こそが、宣言の真の力の源泉です。
4.1 日本における宣言の影響
日本において、ヘルシンキ宣言は医学研究倫理の根幹として深く浸透しています。
- 公式な受容と普及: 日本医師会は、ヘルシンキ宣言の公式日本語訳を提供し、その普及に努めてきました。また、1975年の東京総会を主催するなど、宣言の改訂プロセスにも積極的に関与し、国際的な倫理基準の形成に貢献してきました。
- 国内指針の基盤: 厚生労働省などが定める「人を対象とする生命科学・医学系研究に関する倫理指針」といった国の主要な研究倫理指針は、その前文や基本方針において、ヘルシンキ宣言の趣旨を尊重し、その精神に則って策定されていることを明確に謳っています 14。日本の大学や研究機関では、研究を実施する際の倫理審査において、ヘルシンキ宣言の原則に準拠していることが承認の必須条件とされています。
- 患者・市民の視点の導入: 近年、日本では、宣言の原則をさらに発展させ、患者や市民の視点を強化しようとする動きが活発化しています 32。ビッグデータやAIを活用した研究が進む中で、プライバシー保護の強化、研究プロセスへの市民参画の促進、インフォームド・コンセントを基盤とした共同意思決定(シェアード・ディシジョン・メイキング)の確立などが、今後の重要な課題として議論されています。
4.2 米国の応答:ベルモント・レポートとコモン・ルール
米国では、タスキギー梅毒研究をはじめとする国内での非倫理的な研究が社会問題化したことを受け、ヘルシンキ宣言の精神を汲みつつも、独自の倫理的・法的枠組みを構築しました。
- ベルモント・レポート(1979年): タスキギー事件の反省から設立された「生物医学および行動研究における被験者保護のための国家委員会」は、1979年に「ベルモント・レポート」を発表しました。このレポートは、ニュルンベルク綱領やヘルシンキ宣言に示された複雑な倫理原則を、より体系的で応用しやすい3つの核となる原則に集約した点で画期的でした。その3原則とは、「人格の尊重(Respect for Persons)」(個人の自律性を尊重し、脆弱な人々を保護する)、「善行(Beneficence)」(危害を加えず、利益を最大化する)、そして「正義(Justice)」(研究のリスクと利益を公平に分配する)です 。この哲学的整理は、研究倫理の議論に明快な分析的枠組みを提供しました。
- コモン・ルール(45 CFR 46): ベルモント・レポートで示された3原則は、その後、「被験者保護のための連邦政策」、通称「コモン・ルール」(連邦規則第45編第46部)として米国の連邦法に法制化されました 。この規則は、連邦政府の資金提供を受けるすべての研究に適用され、事実上、米国内の学術研究における倫理基準となっています。コモン・ルールは、施設内倫理審査委員会(IRB)による審査の義務化、文書によるインフォームド・コンセントの取得と記録、そして妊婦、囚人、子どもといった特に脆弱な立場にある被験者に対する追加的な保護規定(Subpart B, C, D)などを定めており、ヘルシンキ宣言の主要な原則を法的に強制力のある形で具体化しています。
4.3 欧州の調和:EU臨床試験規則とEMAガイダンス
欧州連合(EU)では、ヘルシンキ宣言の原則は、加盟国全体で調和された規制システムの倫理的な背骨として機能しています。
- 医薬品の臨床試験の実施に関する基準(GCP)の基盤: ヘルシンキ宣言の原則は、日米EUの規制当局が協調して策定した「医薬品の臨床試験の実施に関する基準(ICH-GCP)」の倫理的な基礎をなしています。ICH-GCPは、臨床試験の品質と倫理性を保証するための国際標準であり、欧州での医薬品開発において遵守が必須です。
- EU臨床試験規則(CTR): EU域内で実施されるすべての臨床試験を規律する「臨床試験規則(Regulation (EU) No 536/2014)」は、その前文において、「臨床試験はヘルシンキ宣言に定められた倫理原則に従って実施されなければならない」と明確に規定しています。これにより、宣言の原則はEU法の一部として法的拘束力を持つことになります。インフォームド・コンセントの取得、倫理委員会による承認、被験者の権利保護など、宣言の核となる要件が法的に義務付けられています。
- 欧州医薬品庁(EMA): EUにおける医薬品の審査・監督を担う欧州医薬品庁(EMA)は、医薬品の販売承認申請のために提出されるすべての臨床試験データが、ヘルシンキ宣言を含む倫理基準に準拠して得られたものであることを前提としています。EMAが発行する多岐にわたる科学的ガイドラインの根底には、この倫理的枠組みが暗黙的かつ明示的に存在しており、倫理に反する研究データは承認審査の根拠として認められません。
表2:日米EUの規制におけるヘルシンキ宣言の原則の比較分析
| 主要なヘルシンキ宣言の原則 | 日本(生命科学・医学系研究倫理指針等) | 米国(コモン・ルール 45 CFR 46) | 欧州連合(EU臨床試験規則等) |
| インフォームド・コンセント | ・文書による同意取得を原則義務化 ・代理人による同意(代諾)に関する詳細な規定 ・人間の尊厳の尊重を強調 | ・文書による同意取得と記録を法的に要求(45 CFR 46.116/117) ・同意取得プロセスの詳細な要件を規定 ・同意免除の厳格な条件を設定 | ・臨床試験実施の前提条件として法的に義務化 ・同意能力のない被験者や未成年者からの同意取得に関する特定の規則を制定 ・同意はいつでも自由に撤回可能 |
| 独立した倫理審査 | ・研究機関に倫理審査委員会の設置を義務化 ・研究計画の事前審査・承認が必須 ・委員会の構成要件(外部委員、非専門家を含む)を規定 | ・施設内倫理審査委員会(IRB)の設置と登録を法的に義務化 ・IRBによる研究の事前承認および継続審査が必須 ・IRBの機能、運営、記録保持に関する詳細な連邦規則 | ・倫理委員会による承認を臨床試験開始の必須要件として法制化 ・多国間共同試験の場合、各加盟国の倫理委員会の関与を規定 ・委員会の独立性と専門性を保証 |
| 脆弱な集団の保護 | ・子ども、同意能力のない者等を「特に配慮を要する者」と位置づけ、保護策を要求 ・研究に含める必要性・合理性の説明を要求 | ・特定の脆弱な集団に対する追加保護規定を法典化 - Subpart B: 妊婦、胎児 - Subpart C: 囚人 - Subpart D: 子ども | ・同意能力のない者、未成年者、妊婦・授乳婦、緊急状況下の被験者に対する特別な保護措置を法的に規定 ・これらの集団を対象とする研究の正当化に関する厳格な要件 |
| リスク・ベネフィット評価 | ・研究によって生じる負担・リスクを最小化し、期待される利益が上回ることを倫理審査委員会が判断 ・継続的なモニタリングを要求 | ・リスクが予測される利益に対して合理的であることをIRBが判断(45 CFR 46.111) ・研究から生じるリスクと利益のみを評価対象とする ・被験者の安全を確保するためのデータモニタリング計画を要求 | ・予測される利益と公益が、被験者のリスクと負担を上回ることを証明することが法的要件 ・リスク最小化の原則を適用 ・安全性に関する継続的な報告義務 |
第5章 ヘルシンキ宣言の永続的重要性とその未来
ヘルシンキ宣言は、単なる歴史的文書ではなく、現代においてもなお、医学研究の倫理的実践を導くための不可欠な羅針盤であり続けています。その核となるレガシーを再確認するとともに、21世紀の科学技術がもたらす新たな倫理的挑戦に、宣言がどのように向き合っていくのかを考察することは極めて重要です。
5.1 個人の優先:宣言の核となるレガシー
ヘルシンキ宣言が医学史に残した最も不朽の貢献は、その倫理観の核心にあります。すなわち、研究に参加する個人の権利、安全、そして尊厳は、何ものにも侵されることのない絶対的な価値であり、研究者は常にそれを保護する義務を負うという、揺るぎない倫理基準を確立したことです。
この「個人優先の原則」は、研究に関わるすべての関係者—個々の研究者から、研究機関、資金提供団体、そして学術雑誌の編集者に至るまで—が共有すべき道徳的コンパスとして機能します。宣言の原則に反して行われた研究報告は、学術雑誌への掲載を受理されるべきではないという規定は、倫理規範が研究エコシステム全体に浸透するための強力なメカニズムとなっています。それは、知識の探求という崇高な目的が、決して人間の尊厳を犠牲にしてはならないという、人類共通の誓約なのです。
5.2 21世紀における挑戦
宣言の原則は、その普遍性にもかかわらず、現代の科学技術の急速な進展によって、常に新たな解釈と適用を迫られています。
- ビッグデータ、バイオバンク、AI: 何百万人もの健康情報を含む巨大なデータベースや、AIアルゴリズムの訓練に用いられるデータを二次利用する際、「インフォームド・コンセント」はどのように適用されるべきでしょうか。一度同意すれば、将来のあらゆる研究に無制限に利用されてしまうのか。宣言の近年の改訂では、データや生体試料の利用に関する同意のあり方が繰り返し議論されており 12、これは今後も研究倫理における最大の課題の一つであり続けるでしょう。
- グローバル化する臨床試験と健康の公平性: 豊かな国の研究依頼者がスポンサーとなり、低所得国で臨床試験が実施される場合、「正義」の原則はどのように確保されるべきか。研究から得られた利益が、リスクを負担した現地のコミュニティに還元されず、搾取に終わる危険性は常に存在します。試験後の介入へのアクセス保証や、利益と負担の公平な分配といった原則は、グローバル化した現代において、かつてなく重要な意味を持っています。
- 患者主導研究と市民科学: 患者が単なる研究対象ではなく、研究の計画や実施に積極的に関与するパートナーとなる動きが広がっています。こうした新しい研究モデルにおいて、従来の倫理的監視や科学的妥当性の原則はどのように適用されるべきか。2024年改訂で「意義のある関与」が強調されたのは、この新しい潮流への応答であり、研究倫理のあり方そのものが変革期にあることを示唆しています 25。
5.3 結論:人類の進歩のための生きた倫理
ヘルシンキ宣言は、硬直した規則の集まりではなく、医学という専門職が、知識の探求が二度と人間の尊厳を犠牲にすることのないようにするという誓約を体現した、生きた倫理規範です。それは、医学の進歩が個人を犠牲にすることなく人類に奉仕することを保証するための、絶え間ない倫理的熟慮の枠組みを提供します。
その永続的な力は、宣言の最もシンプルかつ根源的なメッセージに由来します。すなわち、治療においてであれ研究においてであれ、「私の患者の健康を私の第一の関心事とする」という医師の誓いです 16。科学がどれほど進歩し、社会がどれほど変化しようとも、この人間中心の倫理観こそが、ヘルシンキ宣言を未来永劫にわたって医学研究の礎石たらしめる不変の価値なのです。